RESÚMENES
Terapias biológicas actuales y emergentes para la artritis psoriásica
Presentado por: Alice B. Gottlieb, MD, FAADProfessor of Dermatology, New York Medical College, Metropolitan Hospital, New York, NY, USA
Ixekizumab
En diciembre de 2017, ixekizumab fue aprobado para la artritis psoriásica. Se administra mediante inyección subcutánea y tiene una dosis recomendada de 160 mg (dos inyecciones de 80 mg) en la semana 0, seguida de inyecciones de 80 mg cada 4 semanas. Si los pacientes tienen psoriasis en placa coexistente de moderada a grave, se debe emplear el régimen de dosis para la psoriasis en placa. No es necesario que los pacientes tomen metotrexato concurrente, ya que el ixekizumab se puede utilizar con o sin metotrexato.
Los estudios clínicos para el ixekizumab han demostrado hallazgos significativos que se recogen en la Tabla 1.1
Las variables de evaluación para la artritis periférica fueron significativas entre los pacientes sin tratamiento con agentes biológicos que recibieron ixekizumab del Colegio Americano de Reumatología 20 (American College of Rheumatology 20, ACR20) una respuesta del 57,9% y una buena puntuación total modificada (mTSS, por sus siglas en inglés) de 0,17 en el grupo con ixekizumab, en comparación con 31,1% y 0,49 respectivamente en el grupo con placebo.2 Los pacientes con experiencia biológica también demostraron mejorías con un ACR20 del 53% en el grupo con ixekizumab en comparación con el 19% en el grupo con placebo.3
Secukinumab
El secukinumab está aprobado para su uso en la artritis psoriásica. Se administra por inyección subcutánea y puede o no administrarse con una dosis de carga. Si se administra con una dosis de carga la dosis es de 150 mg cada semana durante 4 semanas y cada 4 semanas después. Sin la dosis de carga, el programa de dosificación es de 150 mg cada 4 semanas. Si los pacientes continúan teniendo artritis psoriásica activa, la dosis se puede aumentar a 300 mg. Si los pacientes tienen psoriasis en placa coexistente de moderada a grave, se debe emplear el régimen de dosis para la psoriasis en placa. El secukinumab se puede administrar con o sin metotrexato.4
El guselkumab es el único medicamento en los ensayos clínicos actuales de la fase 2 para la artritis psoriásica.5 El estudio multicéntrico, aleatorizado y controlado con placebo determinará la eficacia y seguridad del guselkumab en pacientes con artritis psoriásica. El estudio de 4 partes consiste en los siguientes períodos de tratamiento:
- Período de tamisage de 6 semanas
- Período de 24 semanas doble ciego con guselkumab o placebo
- Período de tratamiento activo con guselkumab de 20 semanas
- Periodo de seguimiento de 12 semanas.
El estudio incluyó una opción de escape temprano en la que los pacientes podían cambiar a la terapia abierta con ustekinumab 45 mg o 90 mg en las semanas 16, 20, 32 y 44 para los pacientes con una mejoría <5% desde el inicio en los recuentos de articulaciones sensibles e inflamadas en la semana 16. La eficacia del guselkumab se evaluará mediante la respuesta ACR20 en la semana 24.
El abatacept es un modulador selectivo de la coestimulación de células T con un mecanismo de acción al principio del proceso inflamatorio para reducir la activación de las células T.6 Los hallazgos iniciales del estudio son relativamente prometedores con un ACR20 de 39,4% y una progresión sin rayos X de 42,7% en comparación con el placebo con ACR20 de 22,3% y 32,7%, respectivamente.7 PASI 75 pareció más pronunciado con abatacept con 16,4% en comparación con 10,1% en el placebo.
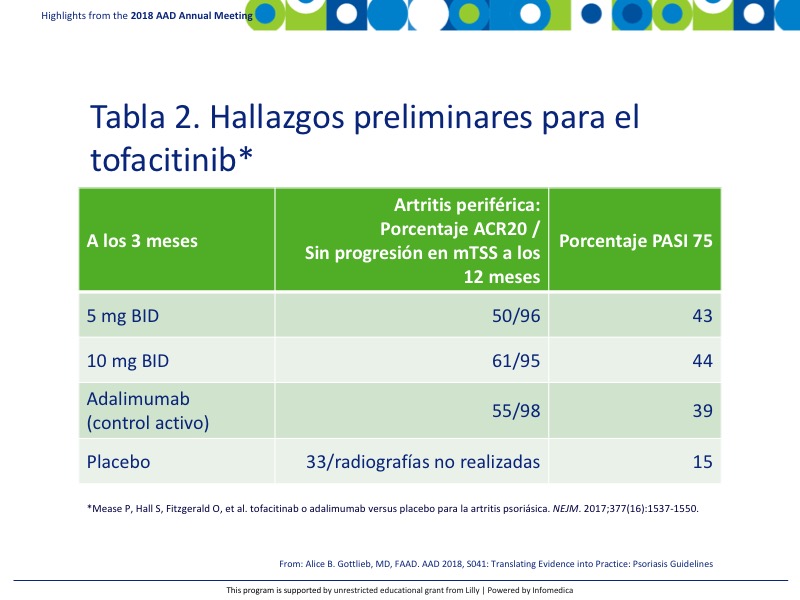
El tofacitinib es un inhibidor de la quinasa JAK actualmente aprobado para la artritis reumatoide. Se están realizando estudios iniciales para determinar su eficacia en la artritis psoriásica. Los hallazgos preliminares en pacientes no tratados biológicamente se recogen en la Tabla 2.8
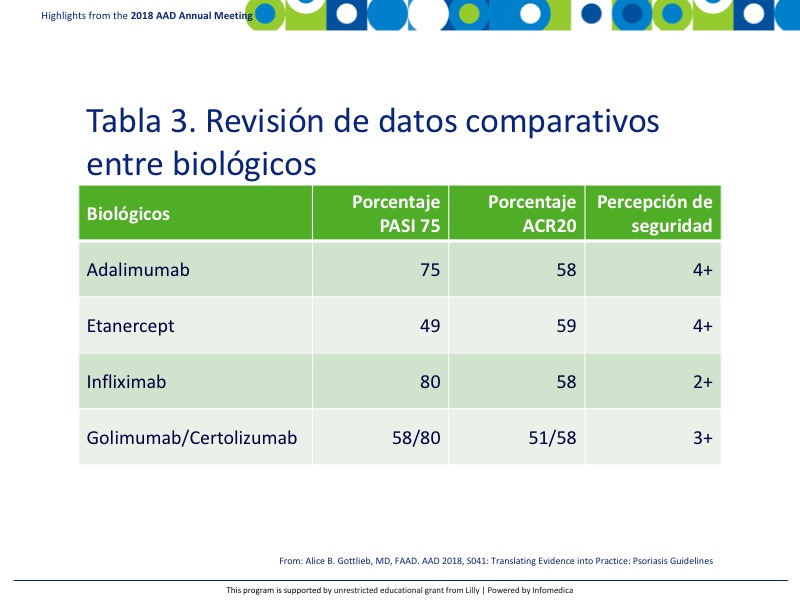
Hay un puñado de inhibidores del TNF que están actualmente aprobados para la artritis psoriásica, incluyendo adalimumab, etanercept, infliximab, golimumab y certolizumab. La Tabla 3 muestra la revisión de datos comparativos en las variables principales de evaluación PASI 75 y ACR20.9
Mensajes clave
- Cada vez hay más agentes disponibles para la psoriasis que están siendo evaluados para el tratamiento de la artritis psoriásica.
- Aunque se ha demostrado que todos los productos biológicos examinados son eficaces para el tratamiento de la artritis periférica y la manifestación cutánea de la psoriasis, el tofacitinib y el abatacept no parecieron mostrar mejoría en la piel.

REFERENCIAS
Divulgación de información actual: La presentadora ha informado que además de ser asesora, también celebra acuerdos con la junta asesora y participa en la oficina portavoz de Janssen Inc, Celgene Corp, Bristol Myers Squibb Co, Beiersdorf, Inc, Abbvie, UCB, Novartis, Incyte, Lilly, Reddy Labs, Valeant, Dermira, Allergan y Sun Pharmaceutical Industries.
Escrito por: Debbie Anderson, PhD
Revisado por: Victor Desmond Mandel, MD
