RÉSUMÉS
Traitements biologiques actuels et émergents pour le rhumatisme psoriasique
Présenté par: Alice B. Gottlieb, MD, FAADProfessor of Dermatology, New York Medical College, Metropolitan Hospital, New York, NY, USA
Ixékizumab
En décembre 2017, l’ixékizumab a été approuvé pour le rhumatisme psoriasique. Il est administré par voie sous-cutanée et la dose recommandée est de 160 mg (deux injections de 80 mg) à la Semaine 0, suivie d’une injection de 80 mg toutes les 4 semaines. Si les patients souffrent concomitamment de psoriasis en plaques de modéré à grave, il faut utiliser la posologie pour le psoriasis en plaques. Les patients n’ont pas besoin de prendre aussi du méthotrexate étant donné que l’ixékizumab peut être utilisé avec ou sans cet agent.
Les études cliniques sur l’ixékizumab ont donné des résultats significatifs qui sont présentés au tableau 11.
Les paramètres pour l’arthrite périphérique étaient significatifs entre les patients sous ixékizumab prenant un agent biologique pour la première fois, avec une réponse ACR20 (American College of Rheumatology 20) de 57,9 % et un score total de Sharp modifié (STSm) de 0,17, contre 31,1 % et 0,49 pour le groupe placebo2. Les patients qui avaient déjà reçu des agents biologiques ont aussi manifesté des améliorations, avec un score ACR20 de 53 % pour le groupe ixékizumab, contre 19 % pour le groupe placebo3.
Sécukinumab
Le sécukinumab est approuvé pour les patients atteints de rhumatisme psoriasique. Il est administré par voie sous-cutanée, avec ou sans dose de charge. S’il est administré avec une dose de charge, la posologie est de 150 mg par semaine pendant 4 semaines, puis toutes les 4 semaines par la suite. En l’absence de dose de charge, la posologie est de 150 mg toutes les 4 semaines. Si les patients continuent de souffrir de rhumatisme psoriasique évolutif, la posologie peut être augmentée à 300 mg. Si les patients présentent un psoriasis en plaques de modéré à grave concomitant, il faut utiliser la posologie pour le psoriasis en plaques. Le sécukinumab peut être administré avec ou sans méthotrexate4.
Le guselkumab est le seul médicament qui fait actuellement l’objet d’un essai clinique de phase 2 sur le rhumatisme psoriasique5. L’étude multicentrique, randomisée, avec témoins sous placebo, déterminera l’efficacité et l’innocuité du guselkumab chez les patients atteints de rhumatisme psoriasique. L’étude se déroulera en quatre volets comme suit:
- période de sélection: six semaines
- période sous guselkumab ou placebo à double insu: 24 semaines
- période de traitement actif par guselkumab: 20 semaines
- période de suivi: 12 semaines.
Le protocole de l’étude prévoyait une option de sortie précoce où les patients pouvaient passer au traitement à étiquetage en clair par ustékinumab 45 mg ou 90 mg aux Semaines 16, 20, 32 et 44 lorsqu’ils présentaient une amélioration < 5 % par rapport à leurs valeurs de référence pour ce qui est du nombre d’articulations sensibles et enflées à la Semaine 16. L’efficacité du guselkumab sera évaluée selon la réponse ACR20 à la Semaine 24.
L’abatacept est un comodulateur sélectif de la stimulation des lymphocytes T qui agit dès les premiers stades du processus inflammatoire pour réduire l’activation des lymphocytes T6. Les résultats de l’étude initiale sont assez prometteurs, avec une réponse ACR20 de 39,4 % et une non-progression radiographique de 42,7 %, comparativement au placebo (réponse ACR20 de 22,3 % et 32,7 %, respectivement)7. La réponse PASI 75 a semblé plus marquée avec l’abatacept, soit 16,4 % contre 10,1 % avec le placebo.
Le tofacitinib est un inhibiteur de la Janus kinase (JAK) actuellement approuvé pour la polyarthrite rhumatoïde. Des études préliminaires sont en cours pour en déterminer l’efficacité pour le rhumatisme psoriasique. Les résultats initiaux chez les patients n’ayant encore jamais pris d’agents biologiques sont présentés au tableau 28.
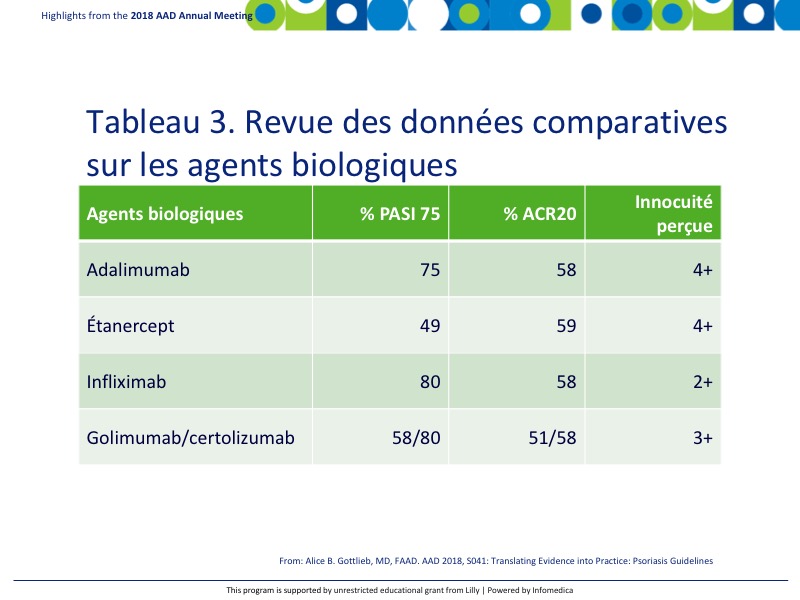
Quelques anti-TNF sont actuellement approuvés pour le rhumatisme psoriasique, notamment l’adalimumab, l’étanercept, l’infliximab, le golimumab et le certolizumab. Le tableau 3 présente les données comparatives pour les paramètres principaux PASI 75 et ACR209.
Messages clés
- Un nombre croissant d’agents sont offerts pour le psoriasis et font l’objet d’études pour le traitement du rhumatisme psoriasique.
- Même si tous les agents biologiques étudiés se sont révélés efficaces pour le traitement de l’arthrite périphérique et des manifestations dermatologiques du psoriasis, le tofacitinib et l’abatacept n’ont pas semblé améliorer l’état de la peau.


RÉFÉRENCES
Intérêts concurrents: La présentatrice a indiqué être consultante et membre de comités consultatifs, en plus de participer aux bureaux des conférenciers pour Janssen Inc, Celgene Corp, Bristol Myers Squibb Co, Beiersdorf, Inc, Abbvie, UCB, Novartis, Incyte, Lilly, Reddy Labs, Valeant, Dermira, Allergan et Sun Pharmaceutical Industries.
Rédigé par: Debbie Anderson, PhD
Révisé par: Victor Desmond Mandel, MD
