REPORT
Terapie biologiche attuali ed emergenti per l’artrite psoriasica
Presentato da: Alice B. Gottlieb, MD, FAADProfessor of Dermatology, New York Medical College, Metropolitan Hospital, New York, NY, USA
Ixekizumab
Nel dicembre 2017 ixekizumab è stato approvato per l’artrite psoriasica. Viene somministrato per mezzo di iniezioni sottocutanee e ha un dosaggio raccomandato di 160 mg (due iniezioni da 80 mg) alla settimana 0, seguiti da iniezioni di 80 mg ogni 4 settimane. Se i pazienti hanno una coesistente psoriasi a placche moderata-grave, dovrebbe essere impiegato il regime di dosaggio per la psoriasi a placche. I pazienti non necessitano di essere in terapia concomitante con metotrexato poiché ixekizumab può essere utilizzato anche senza di esso.
Gli studi clinici per ixekizumab hanno dimostrato risultati significativi che sono riportati nella Tabella 1.1
I parametri di valutazione per l’artrite periferica risultavano significativi tra pazienti vergini ai biologici in terapia con ixekizumab con una risposta American College of Rheumatology 20 (ACR20) del 57,9% e con un punteggio modified total sharp (mTSS) di 0,17 nel gruppo ixekizumab in confronto con il 31,1 e lo 0,49% rispettivamente nel gruppo placebo.2 Anche i pazienti che avevano assunto agenti biologici hanno dimostrato miglioramenti con un ACR20 del 53% nel gruppo ixekizumab in confronto con il 19% nel braccio placebo.3
Secukinumab
Secukinumab è approvato per l’utilizzo nell’artrite psoriasica. Viene somministrato attraverso iniezioni sottocutanee e può essere o meno somministrato con una dose di carico. Se somministrato con una dose di carico il dosaggio è 150 mg ogni settimana per 4 settimane e in seguito ogni 4 settimane. Senza la dose di carico, lo schema di dosaggio è 150 mg ogni 4 settimane. Se i pazienti continuano ad avere artrite psoriasica attiva, il dosaggio può essere aumentato a 300 mg. Se i pazienti presentao una psoriasi a placche moderata-grave concomitante, dovrebbe essere impiegato il regime di dosaggio per la psoriasi a placche. Secukinumab può essere somministrato con o senza metotrexato.4
Guselkumab è l’unico farmaco attualmente in studi clinici di fase 2 per l’artrite psoriasica.5 Lo studio multicentrico, randomizzato, controllato con placebo determinerà l’efficacia e la sicurezza di guselkumab in pazienti con artrite psoriasica. Lo studio in 4 parti consiste nei seguenti periodi di trattamento:
- Periodo di screening di 6 settimane
- Periodo di 24 settimane con guselkumab in doppio cieco o con placebo
- Periodo di trattamento attivo di 20 settimane con guselkumab
- Periodo di follow-up di 12 settimane.
Lo studio comprende un’opzione di abbandono precoce in cui i pazienti possono passare a terapia open-label con ustekinumab 45 mg o 90 mg alle settimane 16, 20, 32 e 44 per pazienti con un miglioramento <5% dal basale nelle conte delle articolazioni dolenti e tumefatte. L’efficacia di guselkumab verrà valutata mediante la risposta ACR20 alla settimana 24.
Abatacept è un modulatore selettivo per la costimolazione delle cellule T con un meccanismo di azione precoce nel processo infiammatorio per ridurre l’attivazione delle cellule T.6 Risultati di studi iniziali sono relativamente promettenti con un ACR20 del 39,4% e una progressione non raggi X del 42,7% in confronto con il placebo con ACR20 22,3 e 32,7%, rispettivamente.7 PASI 75 appariva più pronunciata con abatacept con 16,4% in confronto con 10,1% con placebo.
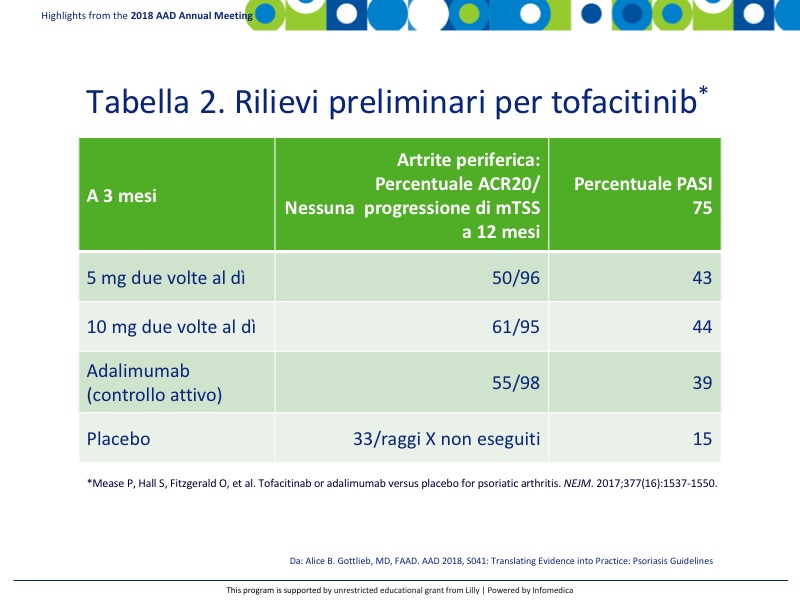
Tofacitinib è un inibitore della JAK chinasi attualmente approvato per l’artrite reumatoide. Studi iniziali sono in corso per determinarne l’efficacia per l’artrite psoriasica. Vengo riportati i risultati preliminari in pazienti vergini ai biologici nella Tabella 2.8
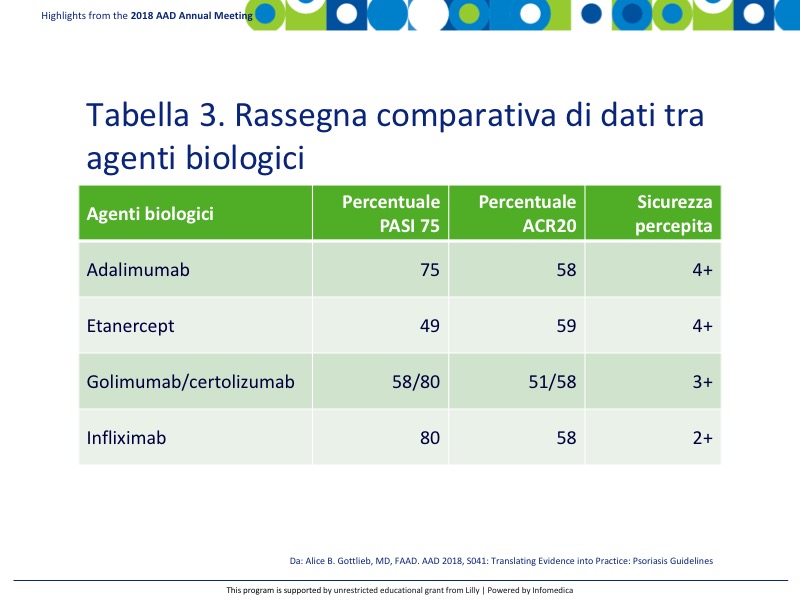
È presente una manciata di inibitori TNF che sono al momento approvati per l’artrite psoriasica, compresi adalimumab, etanercept, infliximab, golimumab e certolizumab. La Tabella 3 mostra la revisione comparativa dei dati relative ai parametri di valutazione primaria PASI 75 e ACR20.9
Messaggi chiave
- È presente una quantità crescente di agenti disponibili per la psoriasi che sono in valutazione per il trattamento nell’artrite psoriasica.
- Mentre tutti gli agenti biologici passati in rassegna si sono dimostrati efficaci nel trattamento sia dell’artrite periferica sia delle manifestazioni relative alla pelle della psoriasi, non è apparso che tofacitinib e abatacept abbiano migliorato il quadro relativo alla pelle.

REFERENZE
Dichiarazione della relatrice: la relatrice ha dichiarato consulenze, rapporti con i comitati consultivi e presenza nel panel di relatori per Janssen Inc, Celgene Corp, Bristol Myers Squibb Co, Beiersdorf, Inc, Abbvie, UCB, Novartis, Incyte, Lilly, Reddy Labs, Valeant, Dermira, Allergan e Sun Pharmaceutical Industries.
Scritto da: Debbie Anderson, PhD
Rivisto da: Victor Desmond Mandel, MD
