RESÚMENES
Apremilast para el síndrome de Behçet: Un estudio aleatorizado, controlado con placebo y doble ciego (RELIEF) de fase III
Presentado por: Yuseuf Yazici, MDClinical Associate Professor, Department of Medicine, Director, Seligman Center for Advanced Therapeutics. New York University School of Medicine, New York, NY, USA
El síndrome de Behçet es un trastorno inflamatorio poco frecuente, crónico y multisistémico caracterizado por úlceras orales y genitales, lesiones cutáneas, uveítis, artritis y compromiso vascular, del sistema nervioso central y gastrointestinal.1,2 La afección lleva a úlceras orales recurrentes que pueden ser dolorosas y conducir a una reducción de la calidad de vida (CdV).1,2 Apremilast es un inhibidor oral de la fosfodiesterasa 4 que modula varias vías inflamatorias y ha demostrado eficacia en la reducción de úlceras orales en un estudio de fase 2 (NCT00866359). Sin embargo, este estudio preliminar no tuvo poder estadístico para evaluar la eficacia a largo plazo, el efecto sobre otras manifestaciones del síndrome de Behçet o el riesgo de eventos adversos graves poco frecuentes.1
Los resultados preliminares del apremilast vs placebo (estudio RELIEF) para el Síndrome de Behçet fueron presentados en la Academia Americana de Dermatología 2018 en San Diego y están representados a continuación.
Determinar la capacidad de apremilast para reducir el número de úlceras orales en pacientes con síndrome de Behçet durante un período de 64 semanas en comparación con placebo.
Tipo de estudio (NCT02307513)3
- Fase 3
- Doble ciego
- Multicentro
- Controlado con placebo
- Aleatorizado.
Poblaciones de pacientes
- Número total de pacientes inscritos: 207 (104 apremilast vs 103 placebo)
- Adultos con síndrome de Behçet que cumplen con los criterios del grupo de estudio internacional
- Úlceras orales que ocurrieron ≥ veces en los últimos 12 meses
- Candidato para el tratamiento sistémico de las úlceras orales
- Presencia de úlceras ≥ en el cribado y en la segunda visita
- No afección activa de órganos primordiales relacionada con el síndrome de Behçet en los últimos 12 meses
- Tratamiento previo del síndrome de Behçet con ≥1 terapia no biológica.
Medida de resultados primarios
- Área bajo la curva (AUC) para el número de úlceras orales.
Medida de resultados secundarios
- Variación con respecto al valor inicial del dolor de las úlceras bucales, según la escala analógica visual (EAV)
- Puntuación de actividad del síndrome de Behçet (BSAS) en la semana 12
- Índice de actividad actual del síndrome de Behçet (BSCAI) en la semana 12
- Calidad de vida del Síndrome de Behçet (BD QOL) en la semana 12.
Medicamentos/Procedimientos utilizados
- Apremilast 30 mg por vía oral dos veces al día durante 64 semanas.
- Placebo durante las primeras 12 semanas seguido de 52 semanas de 30 mg de apremilast por vía oral, dos veces al día.
Criterios de valoración o resultados primarios
- Las AUC fueron estadísticamente significativas en la semana 12 con apremilast en comparación con el placebo (AUC 129,5 vs 222,1, P<0,001).
- Reducción estadísticamente significativa del número de úlceras con apremilast, en comparación con placebo, para la semana 1 que se mantuvo hasta las 12 semanas (P<0,05).
Criterios de valoración o resultados secundarios
- Reducción estadísticamente significativa de las tasas de dolor oral (cambio con respecto al valor inicial) con apremilast, en comparación con placebo, ya en la semana 1, que se mantuvo durante 12 semanas (-40,7 versus -15,9; P<0,001).
- Valor estadístico significativo en BSAS, BDCAI y BD QOL con apremilast comparado con el placebo a las 12 semanas:
- BSAS -17,4 vs -5,4, P<0,0001
- BDCAI -0,9 vs -0,4, P=0,0335
- BD QOL -3,5 vs -0,5, P=0,0003.
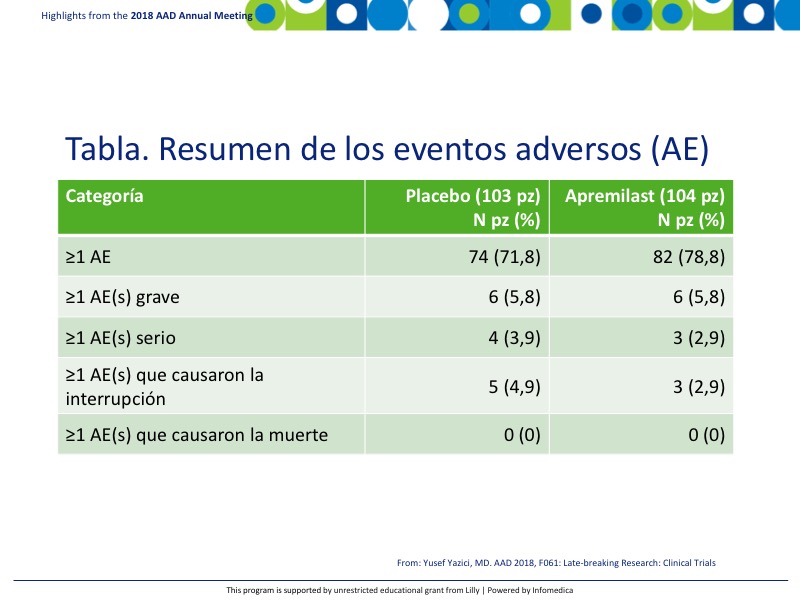
- Hubo una buena paridad entre los eventos adversos (AE) y los AE graves, como puede verse en el cuadro. Ningún AE condujo a la muerte. Los eventos adversos emergentes del tratamiento (TEAE) más comunes que ocurrieron en ≥5% de los pacientes con apremilast fueron diarrea 41%, náuseas 19,2% y dolor de cabeza 14,4%, en comparación con placebo 19,4%, 10,7% y 9,7% respectivamente (Tabla).
Conclusiones
- El estudio RELIEF demostró la eficacia de apremilast en la reducción de úlceras orales en pacientes con síndrome de Behçet.
- A las 12 semanas, se observó valor estadístico significativo en el:
- Número y dolor de las úlceras orales
- Medidas globales de la actividad de la enfermedad
- QOL.
- Los EA y las TEAEs generales fueron comparables entre el placebo y el apremilast y demostraron el perfil consistente conocido del apremilast.
REFERENCIAS
Divulgación de información actual: El presentador ha informado que no existen relaciones relevantes para el contenido de esta presentación.
Escrito por: Debbie Anderson, PhD
Revisado por: Victor Desmond Mandel, MD
