REPORT
Apremilast per la sindrome di Behçet: uno studio di fase III, randomizzato, controllato con placebo, in doppio cieco (RELIEF)
Presentato da: Yuseuf Yazici, MDClinical Associate Professor, Department of Medicine, Director, Seligman Center for Advanced Therapeutics. New York University School of Medicine, New York, NY, USA
La sindrome di Behçet è una condizione infiammatoria multisistemica rara e cronica, caratterizzata da ulcere orali e genitali, lesioni della pelle, uveite, artrite e interessamento vascolare, gastrointestinale e del sistema nervoso centrale.1,2 La condizione conduce a ulcere orali ricorrenti che possono essere dolorose e portare ad una ridotta qualità della vita (QOL).1,2 Apremilast è un inibitore orale della fosfodiesterasi 4 che modula diverse vie infiammatorie e ha dimostrato efficacia nella riduzione delle ulcere orali in uno studio di fase II (NCT00866359). Tuttavia, questo studio preliminare non aveva la potenza per valutare l’efficacia a lungo termine, l’effetto su altre manifestazioni della sindrome di Behçet o il rischio di eventi avversi gravi non comuni.1
I risultati preliminari dello studio di apremilast vs placebo (studio RELIEF) per la sindrome di Behçet sono stati presentati al congresso dell’American Academy of Dermatology 2018 a San Diego e vengono riportati di seguito.
Determinare la capacità di apremilast di ridurre il numero di ulcere orali in pazienti con sindrome di Behçet nell’arco di un periodo di 64 settimane in confronto con placebo.
Tipo di studio (NCT02307513)3
- Fase 3
- In doppio cieco
- Multicentrico
- Controllato con placebo
- Randomizzato.
Popolazione di pazienti
- Numero totale di pazienti arruolati: 207 (104 apremilast vs 103 placebo)
- Adulti con sindrome di Behçet che soddisfacevano i criteri del Gruppo di studio internazionale
- Ulcere orali che si erano verificate ≥3 volte nei 12 mesi precedenti
- Candidati per il trattamento sistemico delle ulcere orali
- Presenza di ≥2 ulcere allo screening ed alla seconda visita
- Nessun interessamento di organo maggiore attivo collegato con la sindrome di Behçet nei 12 mesi precedenti
- Trattamento precedente con ≥1 terapia sistemica non-biologica per la sindrome di Behçet.
Misure di outcome primarie
- Area sotto la curva (AUC) per il numero di ulcere orali.
Misure di outcome secondarie
- Modificazione dal basale del dolore delle ulcere orali, sulla base della VAS (scala visuale analogica - visual analogue scale)
- Punteggio di attività della sindrome di Behçet (Behçet’s Syndrome Activity Score - BSAS) alla settimana 12
- Indice di attività corrente della sindrome di Behçet (Behçet’s Syndrome Current Activity Index - BSCAI) alla settimana 12
- Qualità della vita della sindrome di Behçet (Behçet’s Syndrome Quality-of-Life - BD QOL) alla settimana 12.
Farmaci/Procedure utilizzate
- Apremilast 30 mg per os due volte al dì per 64 settimane.
- Placebo per le prime 12 settimane seguito da 52 settimane di 30 mg di apremilast per os due volte al dì.
Parametri di valutazione o outcome primari
- AUC è risultata statisticamente significativa alla settimana 12 con apremilast in confronto con placebo (AUC 129,5 vs 222,1, p<0,001).
- Una riduzione statisticamente significativa nel numero di ulcere con apremilast, in confronto con placebo, alla settimana 1 che si è mantenuta fino a 12 settimane (p<0,05).
Parametri di valutazione o outcome secondari
- Riduzione statisticamente significativa dei tassi di dolore orale (modificazione dal basale) con apremilast, in confronto con placebo, fin dalla settimana 1, che si è mantenuta fino a 12 settimane (-40,7 vs -15,9, p<0,001).
- Significatività statistica in BSAS, BDCAI, e BD QOL con apremilast in confronto con placebo a 12 settimane:
- BSAS -17,4 vs -5,4, p<0,0001
- BDCAI -0,9 vs -0,4, p=0,0335
- BD QOL -3,5 vs -0,5, p=0,0003.
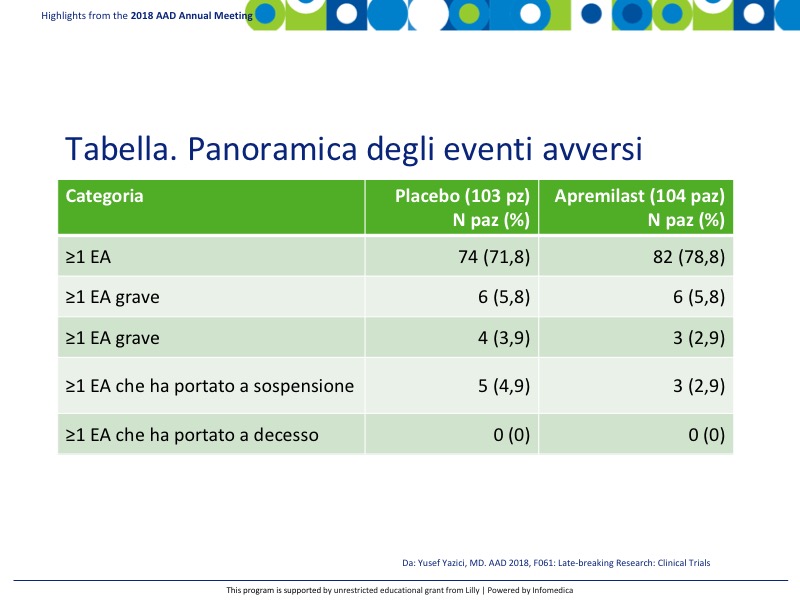
- Era presente una buona equivalenza tra eventi avversi (EA) ed EA gravi come può essere osservato nella Tabella. Nessun EA ha portato a decesso. I più comuni eventi avversi emergenti dal trattamento (EAET) che si sono verificati in ≥5% dei pazienti in terapia con apremilast sono stati diarrea 41%, nausea 19,2%, e cefalea 14,4%, in confronto con il placebo 19,4%, 10,7% e 9,7% rispettivamente (Tabella).
Conclusioni
- Lo studio RELIEF ha dimostrato l’efficacia di apremilast nella riduzione delle ulcere orali in pazienti con sindrome di Behçet.
- Alla settimana 12, è stata osservata la significatività statistica in:
- Numero e dolore delle ulcere orali
- Misure di attività di malattia complessive
- QOL.
- Gli EA e i EAET complessivi erano confrontabili tra il placebo e apremilast e hanno dimostrato il profilo consistente noto di apremilast.
REFERENZE
Dichiarazione del relatore: il relatore ha dichiarato che non esistono potenziali conflitti di interesse pertinenti ai contenuti di questa presentazione.
Scritto da: Debbie Anderson, PhD
Rivisto da: Victor Desmond Mandel, MD
