RESUMOS
Apremilaste para doença de Behçet: Estudo de fase III randomizado, duplo-cego, controlado por placebo (RELIEF)
Apresentado por Yuseuf Yazici, MDClinical Associate Professor, Department of Medicine, Director, Seligman Center for Advanced Therapeutics. New York University School of Medicine, New York, NY, USA
A doença de Behçet é uma doença inflamatória crônica rara, multissistêmica, caracterizada por úlceras orais e genitais, lesões cutâneas, uveíte, artrite e comprometimento gastrointestinal, vascular e do sistema nervoso central.1,2 A doença cursa com úlceras orais recorrentes que podem ser dolorosas e comprometer a qualidade de vida (QOL).1,2 Apremilaste é um inibidor de fosfodiesterase 4 para uso oral, que modula diversas vias inflamatórias e mostrou eficácia na redução de úlceras orais em um estudo de fase 2 (NCT00866359). No entanto, esse estudo preliminar não tinha poder para avaliar a eficácia no longo prazo, o efeito em outras manifestações da doença de Behçet ou o risco de eventos adversos sérios e incomuns.1
Os resultados preliminares do estudo de apremilaste vs placebo (estudo RELIEF) em doença de Behçet foram apresentados no encontro de 2018 da Associação Americana de Dermatologia, em San Diego, e estão descritos abaixo.
Determinar a capacidade de apremilaste de reduzir o número de úlceras orais em pacientes com doença de Behçet, em um período de 64 semanas, comparado a placebo.
Tipo de estudo (NCT02307513)3
- Fase 3
- Duplo-cego
- Multicêntrico
- Controlado por placebo
- Randomizado.
Populações de pacientes
- Número total de pacientes incluídos: 207 (104 apremilast vs 103 placebo)
- Adultos com doença de Behçet que atendiam os critérios do Grupo de estudo internacional
- Ocorrência de úllceras orais (≥3 episódios) nos últimos 12 meses.
- Candidatos a tratamento sistêmico para as úlceras orais
- Presença de ≥2 úlceras na triagem e na segunda visita
- Nenhum comprometimento ativo de órgão importante por doença de Behçet nos últimos 12 meses
- Tratamento prévio com ≥1 terapia não biológica para doença de Behçet.
Medidas de Desfecho Primário
- Área sob a curva (AUC) do número de úlceras orais.
Medidas de Desfecho Secundário
- Variação da dor nas úlceras orais em relação ao basal, pela escala visual analógica (EVA)
- Escore de atividade da doença de Behçet (BSAS) na semana 12
- Índice de atividade atual da doença de Behçet (BSCAI) na semana 12
- Qualidade de vida na doença de Behçet (BD QOL) na semana 12.
Medicamentos/esquemas de tratamento
- Apremilaste, 30 mg por via oral, duas vezes ao dia, por 64 semanas.
- Placebo nas primeiras 12 semanas seguidas por 52 semanas com 30 mg de apremilaste por via oral, duas vezes ao dia.
Desfechos ou resultados primários
- A AUC foi estatisticamente significante na semana 12 com apremilaste comparado a placebo (AUC 129,5 vs 222,1, P<0,001).
- Redução estatisticamente significante no número de úlceras com apremilaste comparado a placebo, a partir da semana 1, mantendo-se até 12 semanas (P<0,05).
Desfechos ou resultados secundários
- Redução estatisticamente significante nas taxas de dor oral (variação em relação ao basal) com apremilast comparado a placebo, já a partir da semana 1, mantendo-se até 12 semanas (-40,7 vs -15,9, P<0,001).
- Significância estatística nos escores BSAS, BDCAI, e BD QOL com apremilaste comparado a placebo após 12 semanas:
- BSAS -17,4 vs -5,4, P<0,0001
- BDCAI -0,9 vs -0,4, P=0,0335
- BD QOL -3,5 vs -0,5, P=0,0003.
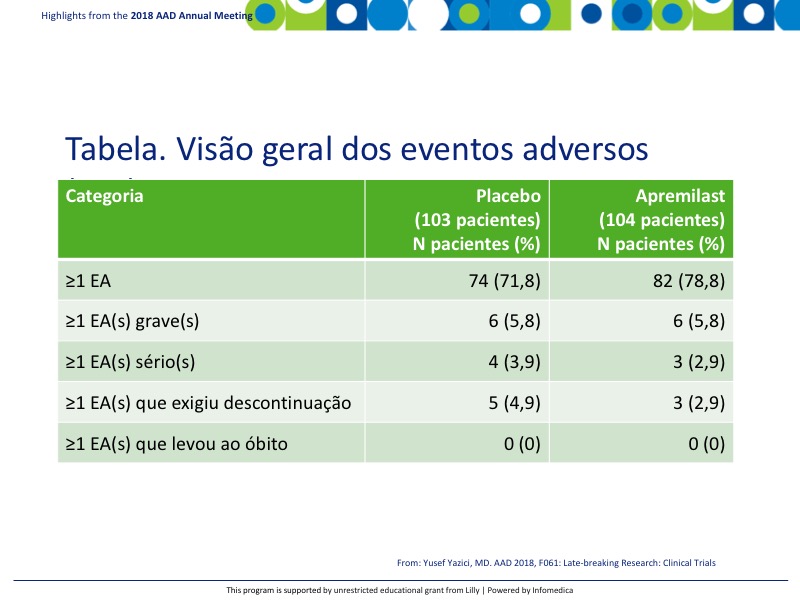
- Houve boa paridade entre os eventos adversos (EAs) e EAs sérios, como se vê na tabela. Não houve EAs que levassem ao óbito. Os eventos adversos emergentes do tratamento (EAET) mais comuns, que ocorreram em ≥5% dos pacientes tratados com apremilaste, foram diarreia, 41%, náusea, 19,2% e cefaleia, 14,4%, comparados a 19,4%, 10,7% e 9,7%, respectivamente, com placebo (Tabela).
Conclusões
- O estudo RELIEF demonstrou a eficácia de apremilaste na redução de úlceras orais em pacientes com doença de Behçet.
- Em 12 semanas, observou-se significância estatística nos seguintes:
- Número de úlceras orais e dor nas úlceras
- Parâmetros gerais de atividade da doença
- Qualidade de vida (QOL).
- A frequência geral de EAs e EAETs foi comparável entre placebo e apremilaste, e demonstrou semelhança com o perfil de segurança já conhecido do apremilaste.
REFERÊNCIAS
Declaração de vínculo: O apresentador declara que não existem vínculos relevantes para o conteúdo desta apresentação.
Redigido por: Debbie Anderson, PhD
Revisado por: Victor Desmond Mandel, MD
