RÉSUMÉS
L’apremilast pour la maladie de Behçet: Étude de phase III randomisée, à double insu, avec témoins sous placebo (RELIEF)
Présenté par: Yuseuf Yazici, MDClinical Associate Professor, Department of Medicine, Director, Seligman Center for Advanced Therapeutics. New York University School of Medicine, New York, NY, USA
La maladie de Behçet est une maladie inflammatoire plurisystémique chronique rare, caractérisée par des ulcères buccaux et génitaux, lésions cutanées, uvéite, arthrite et atteinte de l’appareil circulatoire, du système nerveux central et appareil digestif1,2. Elle cause des ulcères buccaux récurrents qui peuvent être douloureux et nuire à la qualité de vie (QDV)1,2>. L’apremilast est un inhibiteur oral de la phosphodiestérase-4 qui module plusieurs voies inflammatoires et s’est révélé efficace à réduire les ulcères buccaux dans le cadre d’une étude de phase 2 (NCT00866359). Toutefois, cette étude préliminaire n’était pas dotée de la puissance suffisante pour évaluer l’efficacité à long terme, l’effet sur les autres manifestations de la maladie de Behçet ou le risque d’effets indésirables graves et rares1.
Les résultats préliminaires de l’étude RELIEF sur l’apremilast vs placebo pour la maladie de Behçet ont été présentés au Congrès 2018 de l’American Academy of Dermatology à San Diego et sont résumés ci-dessous.
Déterminer la capacité de l’apremilast à réduire le nombre d’ulcères buccaux chez les patients atteints de la maladie de Behçet sur une période de 64 semaines comparativement au placebo.
Type d’étude (NCT02307513)3
- Phase 3
- À double insu
- Multicentrique
- Avec témoins sous placebo
- Randomisée
Populations de patients
- Nombre total de patients recrutés: 207 (104 sous apremilast vs 103 sous placebo)
- Adultes atteints de la maladie de Behçet présentant les critères du Groupe d’étude international
- Ulcères buccaux ≥ 3 fois au cours des 12 mois précédents
- Candidat au traitement systémique pour les ulcères buccaux
- Présence de ≥ 2 ulcères lors de la sélection et de la seconde visite
- Aucune atteinte évolutive majeure des organes due à la maladie de Behçet au cours des 12 mois précédents
- Antécédents de traitement au moyen de ≥ 1 agent non biologique pour la maladie de Behçet
Paramètre principal
- Aire sous la courbe (ASC) pour le nombre d’ulcères buccaux
Paramètres secondaires
- Changement vs départ du score douloureux lié aux ulcères buccaux (échelle analogique visuelle [ÉAV])
- Score d’activité de la maladie de Behçet (BSAS) à la Semaine 12
- Indice d’activité actuelle de la maladie de Behçet (BSCAI) à la Semaine 12
- Qualité de vie liée à la maladie de Behçet (BD QOL) à la Semaine 12
Médicaments/interventions utilisés
- Apremilast 30 mg PO b.i.d. pendant 64 semaines
- Placebo pendant les 12 premières semaines suivi d’apremilast 30 mg PO b.i.d. pendant 52 semaines
Paramètres ou résultats principaux
- L’ASC a été statistiquement significative à la Semaine 12 avec l’apremilast vs placebo (ASC 129,5 vs 222,1, P < 0,001).
- Réduction statistiquement significative du nombre d’ulcères avec l’apremilast vs placebo, au bout d’une semaine et maintenue pendant 12 semaines (P < 0,05).
Paramètres ou résultats secondaires
- Réduction statistiquement significative des scores de douleur orale (changement vs départ) avec l’apremilast, comparativement au placebo, dès la première semaine et maintenue jusqu’à 12 semaines (- 40,7 vs -15,9, P < 0,001).
- Portée statistique pour les score BSAS, BDCAI et BD QOL avec l’apremilast comparativement au placebo à la Semaine 12:
- BSAS -17,4 vs -5,4, P < 0,0001
- BDCAI -0,9 vs -0,4, P = 0,0335
- BD QOL -3,5 vs -0,5, P = 0,0003
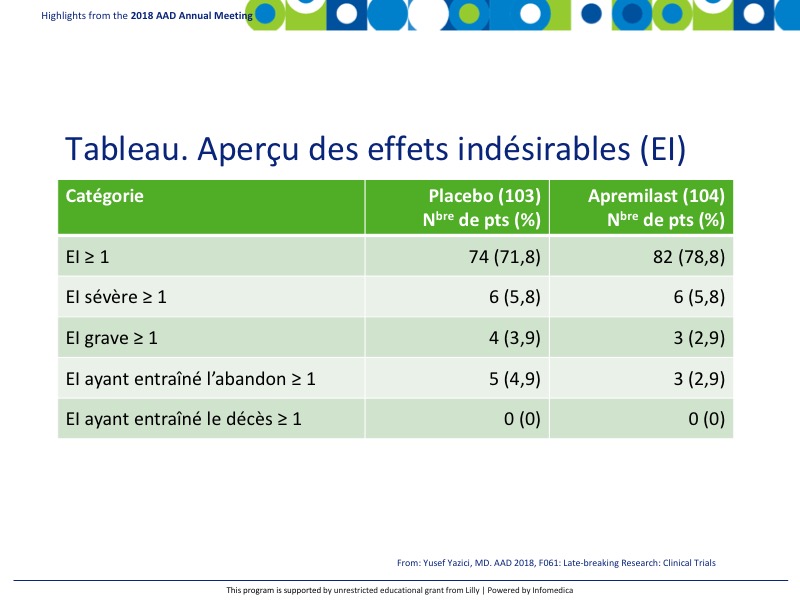
- On a noté une bonne parité entre les effets indésirables (EI) et les EI graves, comme le montre le tableau. Aucun EI ne s’est révélé mortel. Les EI les plus fréquents en lien avec le traitement (EILT) survenus chez ≥ 5 % des patients sous apremilast ont été: diarrhée 41 %, nausées 19,2 % et céphalée 14,4 %, comparativement au placebo 19,4 %, 10,7 % et 9,7 %, respectivement (Tableau).
Conclusions
- L’étude RELIEF a démontré l’efficacité de l’apremilast à réduire les ulcères buccaux chez les patients souffrant de la maladie de Behçet.
- À la semaine 12, la portée statistique a été atteinte pour ce qui est des paramètres suivants:
- nombre d’ulcères buccaux et douleur associée
- paramètres globaux d’activité de la maladie
- Qualité de vie
- Les EI globaux et les EILT ont été comparables entre les groupes sous placebo et apremilast et ont témoigné du profil constant et reconnu de l’apremilast.
RÉFÉRENCES
Intérêts concurrents: Le présentateur ne déclare aucun intérêt concurrent en lien avec le contenu de cette présentation.
Rédigé par: Debbie Anderson, PhD
Révisé par: Victor Desmond Mandel, MD
