REPORTS
Atopische Dermatitis: neue Entwicklungen
Presented by: Lawrence F. Eichenfield, MD, FAAD Professor of Dermatology and Pediatrics. University of California, San Diego. Rady Children’s Hospital, San Diego, CA, USAVor 30 Jahren wurden die erhöhte Aktivität der Phosphodiesterase-4 (PDE-4) und die Verminderung der intrazellulären Konzentration des zyklischen Adenosinmonophosphats (cAMP) in Leukozyten aus dem peripheren Blut von Patienten mit atopischer Dermatitis (AD) entdeckt.1,2 Diese Erkenntnisse führten zur Entwicklung der zielgerichteten Anti-PDE-4-Therapie für die antientzündliche Behandlung der AD. Für die Psoriasis sind diese bereits zugelassen. Inzwischen stehen Langzeitstudien zu PDE-4-Hemmern wie z. B. topischem Crisaborol bei der AD zur Verfügung.3 Bei den Studien AD-301 und AD-302 handelte es sich jeweils um doppelblinde, placebo-kontrollierte Studien zur Sicherheit und Wirksamkeit über 4 Wochen.3 Die entsprechende Langzeitstudie war AD-303, eine unverblindete, einarmige Sicherheitsstudie mit einer Dauer von 48 Wochen.4
In der ersten Studie erhielten die Patienten nach der Randomisierung entweder Crisaborol oder die Trägersubstanz (Placebo) zweimal täglich über 28 Tage. Nach dem Abschluss der Studie wurden die Patienten in die Langzeitstudie eingeschlossen, in der alle Patienten zweimal täglich Crisaborol erhielten und alle 28 Tage neu beurteilt wurden. Crisaborol führte im Vergleich zu Placebo zu einem statistisch signifikanten ISGA-Score von „erscheinungsfreier“ oder „nahezu erscheinungsfreier“ Haut (P < 0,001), mit einer signifikanten Verbesserung bereits an Tag 8.3 Die langfristigen Sicherheitsdaten zeigten eine geringe Häufigkeit von therapieassoziierten unerwünschten Ereignissen (TAUE), keine Unterschiede in Bezug auf die UE über einen längeren Zeitraum, keine Probleme mit Akkumulationen und keine sicherheitsrelevanten Signale bei den Vitalfunktionen und den Laborwerten sowie im Hinblick auf Infektionen oder Neoplasmen.4 Bestimmte Daten zu Crisaborol liegen jedoch bisher noch nicht vor, z. B.:
- vergleichende Wirksamkeit
- Kosteneffizienz
- Wirkung auf bestimmte Körperregionen (Gesicht)
- Probleme mit Hautbrennen
- Daten zu Patienten unter 2 Jahren.
Es gibt weitere PDE-4-Hemmer, die derzeit in klinischen Studien untersucht werden, dazu gehören u. a. die folgenden, die in Tabelle 1 angegeben sind.
Die Ergebnisse der ersten Untersuchungen zu der Salbe Tapinarof (GSK2894512) bei Patienten mit mittelschwerer bis schwerer AD waren bei unterschiedlichen Dosierungen vielversprechend. TAUE wurden bei 13-15 % der Patienten in den Behandlungsgruppen und bei 10 % in den mit Placebo behandelten Gruppen angegeben. In dieser Studie wurden nur sehr wenige Daten zu UE gemeldet.5
Außerdem wurde auch eine Phase-II-Studie zu dem JAK-Inhibitor JTE-052 durchgeführt. Dabei zeigten sich ähnliche Veränderungen im modifizierten Eczema Area and Severity Index (m-EASI) Score gegenüber dem Ausgangswert wie unter Tacrolimus, einer aktiven Kontrollsubstanz. Darüber hinaus war in dieser Studie die Häufigkeit von Reaktionen an der Applikationsstelle viel geringer als unter Tacrolimus.6
Ein weiteres Gebiet, das zurzeit erforscht wird, ist der Prostaglandin-/Leukotrien-Stoffwechsel. Der Arachidonsäure-Stoffwechsel ist verantwortlich für die Umwandlung (Biotransformation) von Phospholipiden in der Plasmamembran in Eicosanoide, einer Gruppe von Entzündungsmediatoren. Während die Leukotriene eine wichtige Rolle bei der Pathogenese von Asthma spielen, wurden Eicosanoide in hoher Konzentration in der Haut von AD-Patienten gefunden.
ZPL-521, ein cytosolischer Phospholipase-A2 (cPLA2)-Inhibitor, verhindert die Umwandlung der Plasmamembran-Phospholipide in Arachidonsäure, die das geschwindigkeitsbestimmende Enzym bei der Eicosanoid-Produktion ist.7
Bei Säuglingen mit hohem Risiko sollte außerdem eine Behandlung zur Prävention der AD ernsthaft in Betracht gezogen werden. Es wurde nachgewiesen, dass durch Anwendung von Emollientien die Häufigkeit der Entwicklung einer AD bei Kindern im Alter von 6 Monaten [relatives Risiko (RR) 0,50; 95-% Konfidenzintervall (KI) 0,28-0,90] (P = 0,02).8 Daraus wurde geschlossen, dass die Emollientientherapie ab der Geburt einen sinnvollen, sicheren und wirksamen Ansatz zur Prävention der AD darstellt.
Dupilumab inhibiert wirksam den IL-4- und den IL-13-(Th2)-Signalweg und ist zur Anwendung bei AD nach einer Initialdosis von 2x 300 mg und nachfolgender Dosierung von 300 mg alle zwei Wochen zugelassen. Die Daten aus der CHRONOS-Studie zeigen eine signifikante Verbesserung des Hautbilds gemessen am Investigator's Global Assessment (IGA) sowie im Hinblick auf die Verbesserung des Eczema Area and Severity Index um 75 % (EASI 75) bzw. 90 % (EASI 90) unter Dupilumab im Vergleich zu Placebo über einen Zeitraum von 52 Wochen.9 Auch die Patienten, die den EASI 75-Endpunkt nicht erreichten, wurden in einer Subanalyse näher betrachtet. Diese Patienten zeigten dennoch ein gutes, sehr gutes oder hervorragendes Ansprechen im Hinblick auf den IGA-Score.
Eine Studie zur Beurteilung der langfristigen Sicherheit von Dupilumab bei Kindern zwischen 6 Monaten und 18 Jahren mit atopischer Dermatitis läuft derzeit noch.10 In dieser unverblindeten Phase-IIa-Studie wurde ebenfalls die Dosierung für Kinder mit AD zwischen 6-11 und 12-17 Jahren untersucht, die nicht auf topische Steroide angesprochen hatten.10 Die IGA-Scores in den einzelnen Gruppe lagen bei 4 bzw. bei 3 oder 4. In beiden Altersgruppen wurden zwei unterschiedliche Dosierungen angewendet: 2 mg/kg und 4 mg/kg. Getestet wurden zwei verschiedene Dosisintervalle: Eine Gruppe erhielt eine Dosis mit einem 8-Wochen-Follow-up (q8w). Die zweite Gruppe erhielt wöchentlich eine Dosis bis Woche 4, gefolgt von einem 8-Wochen-Follow-up. Bei den ersten pharmakokinetischen Untersuchungen waren die Ergebnisse für beide Dosierungen in beiden Altersgruppen vorteilhaft und zeigten keine Auffälligkeiten.
JAK-Inhibitoren wie Baracitinib, Upadacitinib, PF-04965842 und ASN002 haben bei Erwachsenen mit mitteschwerer bis schwerer AD ebenfalls vielversprechende Ergebnisse gezeigt.
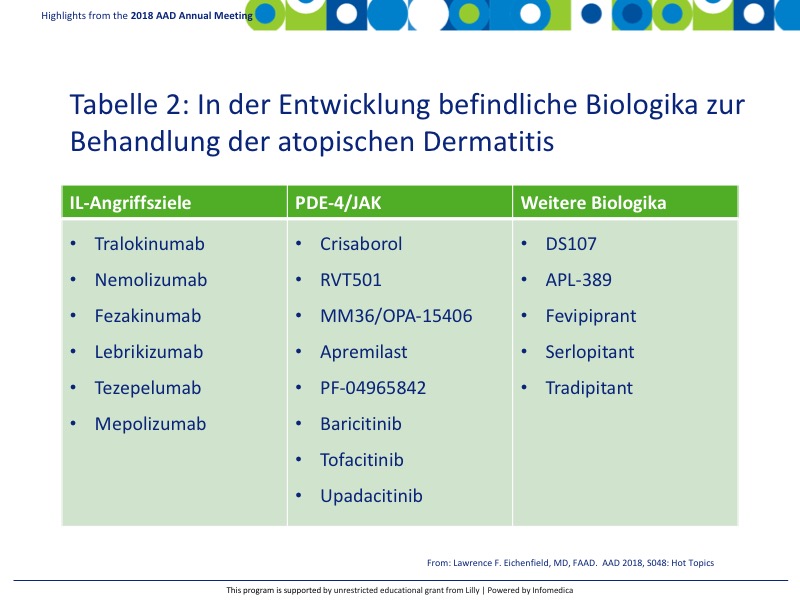
Derzeit werden zahlreiche neu entwickelte Biologika zur Anwendung bei AD geprüft, klinische Studien dazu laufen derzeit (Tabelle 2). Es wird erwartet, dass dieser Bereich weiter wachsen wird und den Patienten in den nächsten Jahren neue Behandlungsoptionen zur Verfügung stehen werden.
Die Anwendung systemischer Therapeutika bei AD sollte zuvor sorgfältig abgewogen werden. Dabei sollten die aktuellen Empfehlungen des International Eczema Council zu Rate gezogen werden, um zu entscheiden, welcher Zeitpunkt und welcher Ansatz am besten für eine systemische Therapie geeignet sind.
Es gibt einen weiteren Forschungsansatz zur Behandlung der AD, der sich auf das Mikrobiom konzentriert. Vorläufige Ergebnisse zeigen, dass auf der Haut ein Koagulase-negatives Staphylococcus-Bakterium vorhanden ist, das so genannte „Lantibiotika“ sezerniert, welche antibiotisch gegenüber Staphylococcus aureus wirken.11 Die Forschung auf diesem Gebiet geht weiter und das Interesse an den Ergebnissen ist groß.
Kernaussagen
- Die Langzeit-Sicherheitsdaten von PDE-4-Hemmern (insbesondere Crisaborol) sind vielversprechend und bieten kaum Anlass zu Bedenken im Hinblick auf die Sicherheit.
- Weitere PDE-4-Hemmer werden derzeit in klinischen Studien untersucht.
- Auch der Prostaglandin-/Leukotrien-Stoffwechselweg wird erforscht, da gezeigt werden konnte, dass die Konzentration von Eicosanoiden in der Haut von AD-Patienten erhöht ist. ZPL-521 wird derzeit als möglicher Therapieansatz untersucht.
- Dupilumab und JAK-Inhibitoren gewinnen im Bereich der Biologika zur Behandlung der AD an Bedeutung. Dupilumab hat positive Ergebnisse gezeigt und wird derzeit bei Kindern und Jugendlichen untersucht. Zahlreiche weitere biologische Arzneimittel befinden sich momentan in der Entwicklung.
- Es hat sich gezeigt, dass sich das Mikrobiom von AD-Patienten von dem bei Gesunden unterscheidet. Die Forschung konzentriert sich zurzeit auf Koagulase-negative Staphylokokkenspezies als möglichen Behandlungsansatz.

REFERENCES
Offenlegungserklärung des Referenten: Der Referent hat angegeben, dass er als Berater oder Prüfer für die Firmen Anacor/Pfizer, Cutanea, Dermavant, Genentech, Galderma Laboratories, Leo, Lilly, Matrisys, Medimedtriks, Morphosys, Novan, Novartis, Otsuka, Regeneron/Sanofi und Ortho Dermatology tätig ist.
Aufgezeichnet von: Debbie Anderson, PhD
Überprüft von: Victor Desmond Mandel, MD
