RÉSUMÉS
Efficacité et innocuité de l’IFX-1, un anticorps monoclonal anti-C5a, dans une étude de phase 2A ouverte chez des patients atteints d’hidrosadénite suppurée grave non candidats à l’adalimumab
Présenté par: Evangelos J. Giamarellos-Bourboulis, MD, PhDFourth Department of Internal Medicine, National and Kapodistrian University of Athens Medical School, Greece
On en sait relativement peu sur la pathogenèse de l’hidrosadénite suppurée (HS). On sait que les patients atteints présentent une augmentation du complément C5a, un puissant amplificateur de l’inflammation qui est corrélation avec la gravité de la maladie. De plus, les taux plasmatiques de C5a stimulent aussi la production de TNFα dans les monocytes. L’IFX-1 est un anticorps monoclonal humain qui se fixe spécifiquement au C5a pour en bloquer l’effet.
Évaluer l’innocuité et la tolérabilité de l’IFX-1 administré sur une période de 8 semaines1.
Type d’étude (NCT03001622)2
- Phase 2A
- Interventionnelle
- Ouverte.
Plan de l’étude
- Sélection:
- Durée: ≤ 2 semaines
- Recrutement total: 12 sujets.
- Période ouverte avec 800 mg d’IFX-1:
- 8 semaines
- Évaluations: Jours 1, 4, 8, 15, 22, 29, 36, 43, 50.
- Période de suivi:
- Durée: 12 semaines
- Évaluations: Jours 78, 108, 134.
Population de patients
- Âge ≥ 18 ans
- Diagnostic d’HS depuis au moins 1 an
- Lésions d’HS affectant au moins 2 régions anatomiques distinctes, dont une au stade de Hurley II ou III
- Nombre d’abcès et nodules (AN) ≥ 3
- Échec primaire ou secondaire du traitement anti-TNF (inhibiteur du facteur de nécrose tumorale) ou patient non candidat à l’adalimumab
- Échec des traitements antimicrobiens précédents.
Paramètres principaux: Innocuité
- Innocuité et tolérabilité de l’IFX-1 administré à des patients souffrant d’HS de modérée à grave
- Effets indésirables (EI).
Paramètres secondaires: Efficacité
- Réponse clinique de l’HS (RC-HS)
- Évaluation globale de l’HS par le médecin (ÉGM-HS)
- Nombre d’AN
- Dimensions des lésions
- Taux de C5a.
Paramètres principaux
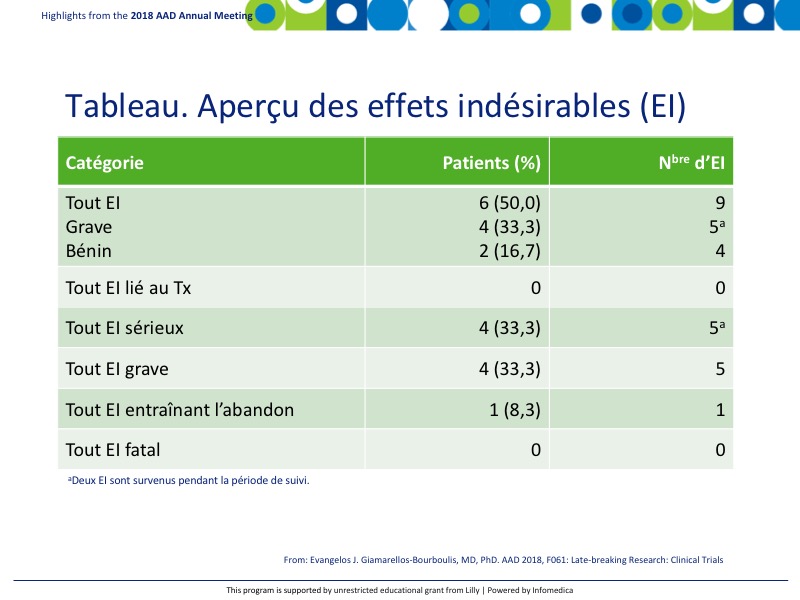
- Des EI ont été notés chez 50 % (6) des patients, 9 incidents au total (Tableau).
- Aucun n’a été jugé en lien avec l’IFX-1 et aucun n’a été fatal.
Paramètres ou résultats secondaires
- Une RC-HS statistiquement significative a été obtenue au Jour 29 comparativement au Jour 22 (P < 0,05), et s’est maintenue tout au long de la période de traitement à étiquetage en clair, jusqu’au Jour 50 chez 9 patients sur 12.
- La RC-HS s’est maintenue à un degré statistiquement significatif tout au long de la période de suivi, P = 0,09 au Jour 134, comparativement au Jour 50 chez 10 patients sur 12.
- La portée statistique a été atteinte pour le nombre d’AN et la dimension des lésions au Jour 50 durant le traitement à étiquetage en clair (P < 0,0001 comparativement au Jour 22) et à nouveau tout au long de la période de suivi jusqu’au Jour 134 (P < 0,0001 comparativement au Jour 22).
- Les taux de C5a ont aussi été significativement moindres au Jour 22 et se sont maintenus jusqu’à au Jour 50 (phase de traitement) comparativement aux valeurs de départ, P = 0,05.
- Les taux de C5a ont commencé à augmenter pendant la période de suivi au Jour 134, mais étaient encore statistiquement inférieurs aux valeurs de départ, P = 0,016.
Conclusions
- L’IFX-1 a été bien toléré dans cette étude et les EI ont été associés à l’HS et non au traitement.
- L’efficacité de l’IFX-1 a donné lieu à des résultats prometteurs, avec un taux de 75 % pour la RC-HS à la fin du traitement et un taux de 83 % pour la RC-HS à la fin de la période de suivi.
RÉFÉRENCES
Intérêts concurrents: Le présentateur a déclaré des honoraires (versés à l’Université d’Athènes) par AbbVie, Biotest, Brahms Gmbh et The Medicines Company; il a reçu une rémunération à titre de consultant pour Astellas Grèce, InflaRx Gmbh, Allemagne et XBiotech (versée à l’Université d’Athènes); et a reçu des subventions indépendantes à la formation versées à l’Université d’Athènes par AbbVie et Sanofi. Il est subventionné par le programme HemoSpec de FrameWork 7 (versé à l’Université d’Athènes) et par Horizon2020 Marie-Curie Grant European Sepsis Academy (versé à l’Université d’Athènes).
Rédigé par: Debbie Anderson, PhD
Révisé par: Victor Desmond Mandel, MD
