REPORT
Efficacia e sicurezza di IFX-1, un anticorpo monoclonale anti-C5a, in uno studio di fase 2A open-label in pazienti con idrosadenite suppurativa grave non eleggibili per la terapia con adalimumab
Presentato da: Evangelos J. Giamarellos-Bourboulis, MD, PhDFourth Department of Internal Medicine, National and Kapodistrian University of Athens Medical School, Greece
È disponibile una quantità limitata di conoscenze consolidate circa la patogenesi dell’idrosadenite suppurativa (hidradenitis suppurativa, HS). Ciò che è noto è che i pazienti con HS hanno un aumento del C5a del complemento, un forte amplificatore dell’infiammazione, che è correlato con la gravità della malattia. Inoltre, il C5a plasmatico promuove anche la produzione di TNF (tumor necrosis factor)-α nei monociti. IFX-1 è un anticorpo monoclonale umano che si lega in modo specifico al C5a bloccando il suo effetto.
Valutare la sicurezza e la tollerabilità di IFX-1 somministrato nell’arco di 8 settimane.1
Tipo di studio (NCT03001622)2
- Fase 2A
- Di intervento
- Open-label.
Disegno di studio
- Screening:
- Durata: ≤2 settimane
- Totale soggetti arruolati: 12 individui
- Periodo open-label con IFX-1 800 mg:
- 8 settimane
- Valutazioni: Giorno 1, 4, 8, 15, 22, 29, 36, 43, 50
- Periodo di follow-up:
- Durata: 12 settimane
- Valutazioni: giorno 78, 108, 134.
Popolazione di pazienti
- Età ≥18 anni
- Diagnosi di HS da almeno 1 anno
- Lesioni HS in almeno 2 distinte aree anatomiche, una delle quali in stadio Hurley II o III
- Conta di ascessi e noduli (abscess and nodule, AN) ≥3
- Insuccesso primario o secondario in terapia con anti-TNF o paziente non eleggibile per adalimumab
- Insuccesso di precedenti trattamenti antimicrobici.
Parametro di valutazione primario: sicurezza
- Sicurezza e tollerabilità della somministrazione di IFX-1 in pazienti con HS moderata-grave
- Eventi avversi (EA).
Parametri di valutazione secondaria: efficacia
- Risposta clinica HS (HiSCR)
- Valutazione medica globale (Physician Global Assessment - PGA) HS
- Conta AN; dimensioni della lesione
- Livelli di C5a.
Parametri di valutazione primaria
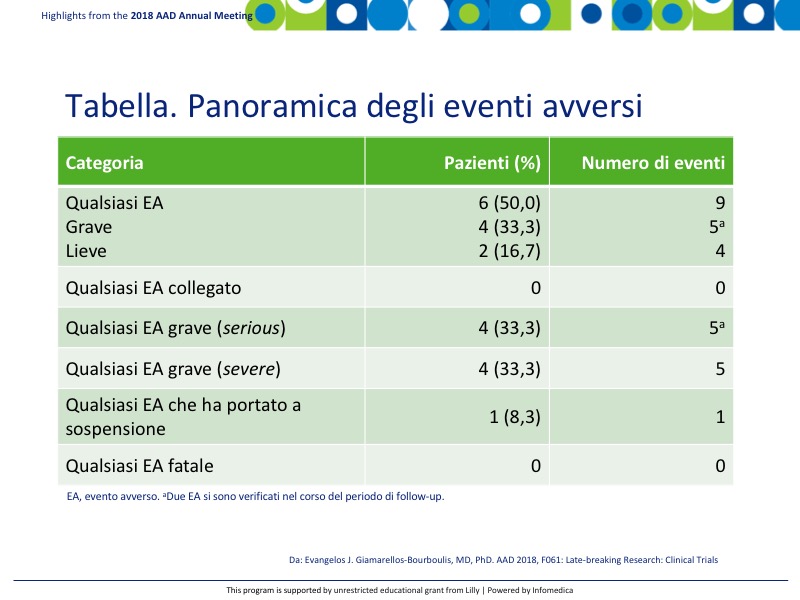
- EA sono stati osservati in 50% (6) pazienti con 9 eventi totali (Tabella).
- Nessuno era collegato con IFX-1 e nessun ea è stato fatale.
Parametri di valutazione secondaria o outcome
- HiSCR statisticamente significativa è stata raggiunta al giorno 29 in confronto con il giorno 22 (p<0,05), ed è stata mantenuta nel corso del periodo di trattamento open-label al giorno 50 in 9 pazienti su 12.
- HiSCR ha mantenuto la significatività statistica fino al periodo di follow-up, p=0,09 al giorno 134 in confronto con il giorno 50 in 10 pazienti su 12.
- È stata osservata la significatività statistica per la conta AN e le dimensioni della lesione sia al giorno 50 durante il trattamento open-label (p<0,0001 in confronto con il giorno 22) sia di nuovo nel corso del periodo di follow-up al giorno 134 (p<0,0001 in confronto con il giorno 22).
- Anche i livelli di C5a erano ridotti in modo significativo al giorno 22 e si sono mantenuti fino al giorno 50 (fase di trattamento) in confronto con il basale, p=0,05.
- I livelli di C5a hanno cominciato a salire nel corso del periodo di follow-up fino al giorno 134 ma erano ancora inferiori in modo statisticamente significativo rispetto ai valori basali originali, p=0,016.
Conclusioni
- IFX-1 è stato ben tollerato in questo studio e gli EA risultavano associati con HS, non con la terapia.
- L’efficacia di IFX-1 ha dimostrato risultati promettenti con una risposta HiSCR del 75% al termine del trattamento e con una risposta HiSCR dell’83% al termine del follow-up.
REFERENZE
Dichiarazione del relatore: il relatore ha riferito di avere ricevuto onorari (versati all’Università di Atene) da AbbVie, Biotest, Brahms GmbH e The Medicines Company; ha ricevuto emolumenti come consulente per Astellas Greece, InflaRx GmbH, Germania e per XBiotech (versati all’Università di Atene); ed ha ricevuto fondi indipendenti per la formazione (versati all’Università di Atene) da AbbVie e Sanofi. Dispone di fondi dal FrameWork 7 program HemoSpec (fondi versati all’Università di Atene) e dall’Horizon2020 Marie-Curie Grant European Sepsis Academy (fondi versati all’Università di Atene).
Scritto da: Debbie Anderson, PhD
Rivisto da: Victor Desmond Mandel, MD
